合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
推薦新聞Info
-
> 牡蠣低分子肽LOPs雙重乳液制備、界面性質檢測及消化吸收特性研究(三)
> 牡蠣低分子肽LOPs雙重乳液制備、界面性質檢測及消化吸收特性研究(二)
> 牡蠣低分子肽LOPs雙重乳液制備、界面性質檢測及消化吸收特性研究(一)
> 不同水解時間的Protamex酶對玉米谷蛋白表面張力、泡沫、理化性質等的影響(三)
> 不同水解時間的Protamex酶對玉米谷蛋白表面張力、泡沫、理化性質等的影響(二)
> 不同水解時間的Protamex酶對玉米谷蛋白表面張力、泡沫、理化性質等的影響(一)
> 新型納米材料2-D納米黑卡在油水界面的微觀驅油機理、界面張力測定(三)
> 新型納米材料2-D納米黑卡在油水界面的微觀驅油機理、界面張力測定(二)
> 新型納米材料2-D納米黑卡在油水界面的微觀驅油機理、界面張力測定(一)
> 燒結礦致密化行為研究:不同堿度條件下熔體的表面張力、表觀黏度值(三)
牡蠣低分子肽LOPs雙重乳液制備、界面性質檢測及消化吸收特性研究(三)
來源:食品科學技術學報 瀏覽 25 次 發布時間:2025-07-04
2結果與分析
2.1 LOPs的界面性質分析
2.1.1 LOPs的潤濕性分析
在食品工業中,濕潤性好的成分可能更容易溶解或分散,從而改善食品的質地、口感或加工性能。LOPs(固相)、水(液相)和空氣(氣相)三相之間形成的接觸角θ可用于表示LOPs對水分的親和能力。當θ小于90°時,固體顆粒優先被水濕潤,θ越小,其在水中的濕潤性及分散性越強;θ大于90°時,固體顆粒的親油性更強;θ在90°左右,固體顆粒具有兩親性,有利于其在界面的吸附與排列。LOPs的固液氣三相接觸角圖片見圖3,LOPs壓片后與超純水和空氣3次接觸形成的接觸角均為銳角,經OSA100型全自動界面黏彈性測量儀測得接觸角的平均值為(30.40±3.17)°。隨著時間的延長,最終水滴完全潤濕了LOPs壓片,實驗表明LOPs具有較好的親水性。
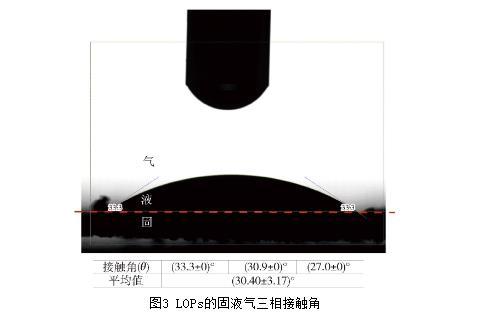
圖3 LOPs的固液氣三相接觸角
2.1.2 LOPs的界面張力分析
蛋白質在油水界面的吸附過程分3個階段:擴散、吸附、界面處展開與重排,進而形成蛋白質吸附層。這是因為蛋白質具有兩親性,疏水側朝向油相,親水性側朝向水相,其能夠吸附在油水界面,降低體系自由能和界面張力。同蛋白質一樣,經酶解獲得的LOPs同樣具有兩親性,其中疏水性氨基酸占氨基酸總量的33.49%,親水性氨基酸占氨基酸總量的57.69%,LOPs的分子質量分布在400~2 300 Da,屬于小分子肽。一般認為小肽在油水界面具有較快的擴散速率,從而表現出更好的表面活性;也有研究認為,較大分子質量的肽會優先吸附到界面上。
不同質量分數的LOPs在油相中的液滴形態及界面張力變化見圖4。由圖4(a)可以判斷LOPs在純化大豆油中存在擴散過程,且隨著LOPs質量分數的增大,液滴的透光性漸無。這可能是因為低質量分數的LOPs之間存在親水性氨基酸的互斥作用,從而使得LOPs傾向于擴散至油水界面處,而隨著LOPs質量分數的繼續增加,LOPs持續擴散至界面處直至體系達到飽和狀態而失去透光性。由圖4(b)可知,無論LOPs的質量分數多大,其在短時間內作用于油水間的界面張力無明顯下降,說明短時間內LOPs并沒有快速吸附到油水界面,LOPs并沒有降低油水間界面張力的能力。
這可能是由于LOPs表現出強親水性,其中的疏水性氨基酸對大豆油中的酸根離子作用力較小,不足以牽引LOPs分子吸附于界面層,而隨著LOPs濃度的增加,其水溶液在大豆油中的界面張力值越來越小,說明其與大豆油之間的相互作用能降低,更傾向于形成穩定的乳液。這可能是因為質量分數越大的LOPs分子間作用力越強,并在界面處形成形狀不規則的肽簇,其中暴露在外的疏水性氨基酸的比例增大。因此,實驗結果表明,LOPs不具有降低純化大豆油-水間界面張力的能力(乳化能力)。因此,LOPs雙重乳液的構建過程中需在中間相(大豆油)添加一定量的乳化劑(PGPR)以形成穩定的W1/O乳液。PGPR是一種油溶性表面活性劑,可引起相間油層的結構變化,可促進油相中微小水滴的自發形成。
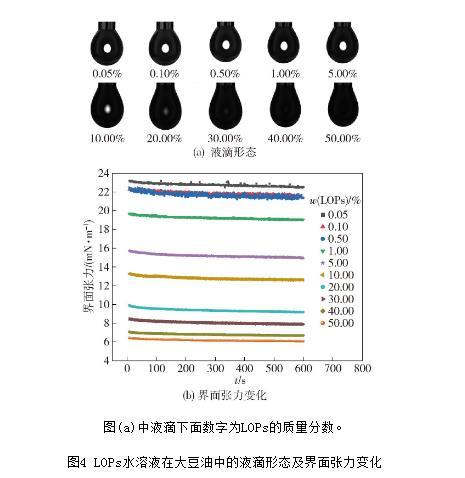
圖(a)中液滴下面數字為LOPs的質量分數。
圖4 LOPs水溶液在大豆油中的液滴形態及界面張力變化
2.2 LOPs雙重乳液體外模擬消化特性分析
2.2.1粒徑分析
在雙乳液遞送系統中,乳液粒徑與分布情況常被用于研究其穩定特性。乳液內相液滴大小是影響系統穩定性的關鍵因素,內相液滴尺寸應適當,數量多,分布均勻以獲得穩定的體系,若液滴尺寸過小,則可能使得液滴之間的碰撞概率增加而破壞乳液的穩定性。PDI是衡量顆粒分散均勻性的關鍵參數,平均粒徑和PDI可反應體系的穩定程度。LOPs雙重乳液經模擬消化后的平均粒徑、PDI和粒徑分布見圖5。由圖5可知,模擬消化前雙重乳液的平均粒徑為(725.5±25.4)nm(PDI=0.419±0.027),顆粒粒徑為1 720 nm的占比最高,達到11.8%。
經模擬口腔消化后,乳液的平均粒徑增大為(791.6±20.9)nm(PDI=0.494±0.058),顆粒粒徑為1 990 nm的占比最高,達到15.0%。這可能是模擬唾液中的α-淀粉酶附著在界面膜表面導致乳液的表觀粒徑略微增大,也可能是由于環境中的OH-附著在界面,與模擬消化液中的鹽離子產生了中和作用,導致乳液的負電荷量減少,使得液滴間的靜電排斥力減弱而導致液滴聚集。經模擬胃液消化后,乳液的平均粒徑顯著增大為(944.6±21.8)nm(PDI=0.418±0.076),此時,顆粒粒徑為1 990 nm的占比仍最高,達到16.2%。以吐溫80為外水相乳化劑制備的LOPs雙重乳液對胃環境中強酸性、胃蛋白酶、膽鹽和脂肪消化酶有較好的抵抗性,其中吐溫80的聚氧乙烯鏈形成網絡,為膽汁鹽和脂肪酶的吸附提供了空間障礙,吐溫80得以延緩脂質的消化。
根據吐溫80在油水界面的性質,我們初步判斷LOPs雙重乳液在胃消化中仍能保存良好的界面膜,進而認為外界環境的低滲作用促使水分通過油相中高濃度的PGPR乳化劑形成膠束轉移至內水相,使得液滴膨脹。此外,胃液中強酸性使得液滴表面質子化,而電解質的靜電屏蔽作用降低了液滴表面電位,導致液滴聚集在一起,這也可能是模擬胃消化后液滴粒徑增大的原因之一。最后,經模擬腸道消化后,乳液的平均粒徑顯著降低為(772.8±21.4)nm(PDI=0.594±0.042),顆粒粒徑為1 990 nm的占比最高,達到11.0%,低于模擬胃消化階段5.2%,說明乳液可能出現破乳現象。
由圖5(b)可知,乳液的粒徑范圍為4 000.0~6 000.0 nm和200.0~400.0 nm的粒徑分布,均大于其他消化階段在此粒徑區間的粒徑分布。這是因為,隨著模擬消化時間的延長,第一階段的吐溫80對腸道消化液具有抵抗性,體系中液滴的聚集,使得粒徑增大至5 600 nm,而后存在第二階段為膽汁鹽和脂肪酶突破吐溫80的網絡結構,液滴出現破乳現象,進而釋放出W1/O型液滴,并使得乳液的平均粒徑下降。液滴破乳,這可能是由于小分子乳化劑膽鹽對W1/O型液滴中的PGPR乳化劑產生競爭作用,吸附在W1/O液滴界面處,使得胰蛋白酶能夠進一步分解脂肪最終釋放出的LOPs液滴。實驗結果表明,在整個體外模擬消化過程中,LOPs雙重乳液在口腔和胃腸道消化階段可能出現聚集和膨脹現象而導致表觀粒徑逐漸增大,在腸道消化階段可能出現破乳現象,使得表觀粒徑減小,說明以雙重乳液結構體系輸送的LOPs在胃部消化降解延緩,延續到小腸消化階段產生破乳降解。
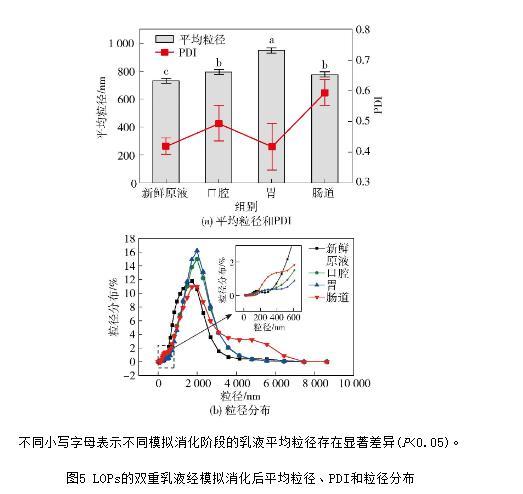
不同小寫字母表示不同模擬消化階段的乳液平均粒徑存在顯著差異(P<0.05)。
圖5 LOPs的雙重乳液經模擬消化后平均粒徑、PDI和粒徑分布
2.2.2 LOPs的包封率分析
包封率是生物活性物質封裝遞送研究中的指標之一,常通過測定內相標記物的流出率作為評價該系統的封裝效率,以外相標記物的流出率評價系統封裝穩定性的能力。本研究采用離心法測定內水相物質LOPs流出率,評價雙重乳液體系在模擬消化階段的封裝效率。LOPs雙重乳液經模擬消化后的包封率見圖6。由圖6可知,與消化前乳液相比,經模擬口腔消化后LOPs雙重乳液的包封率并無顯著降低(包封率最初為88.35%),說明此階段不存在或存在較少內水相物質流出,淀粉酶對雙重乳液的影響較小,此時,乳液界面膜結構良好。經過模擬胃消化后,乳液的包封率出現顯著性下降,這可能是因為長時間的振蕩作用下,存在內水相的LOPs透過界面膜溶出,但乳液仍保留有較高的包封率(76.80%),說明該雙重乳液體系所形成的界面膜結構穩定,能抵抗強酸和胃蛋白酶的作用。最后經過模擬腸道消化后,乳液的包封率顯著降低(30.01%)。說明經過模擬消化過程后,大液滴高度聚集導致界面結構遭到破壞,釋放出內部的W1/O型液滴,繼而油相被腸道中的胰酶解離成游離脂肪酸,釋放出內部包埋的LOPs。
不同小寫字母表示不同模擬消化階段的包封率存在顯著差異(P<0.05)。
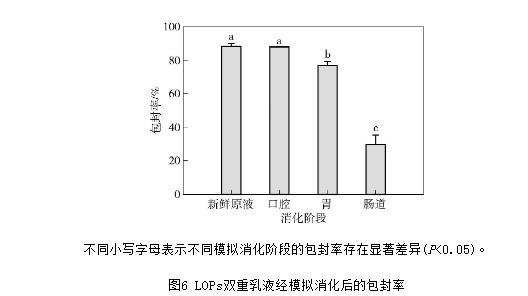
圖6 LOPs雙重乳液經模擬消化后的包封率
2.2.3微觀結構分析
圖7是通過光學顯微鏡拍攝的模擬消化后各階段乳液的形態。圖7(a)顯示,消化前乳液粒徑大小適宜且分布密集,其中高亮處的乳液粒徑較大,此時乳液具有良好的穩定性;圖7(b)顯示,經口腔模擬消化后的乳液分布較為稀疏,但仍存在W1/O/W2雙重乳液結構;觀察圖7(c),經模擬胃消化后的乳液整體粒徑較大且分布相較于圖7(b)密集,同時觀察到中小液滴高密度堆積成帶,說明在強酸和胃蛋白酶存在下,雙重乳液傾向于聚結在一起,這一結果增加了液滴間的聚集率,進而導致乳液粒徑增大;圖7(d)結果顯示,經模擬腸道消化后的乳液失去原有的多相結構,高度聚結后的乳液破裂后釋放出W1/O型液滴,又堆積形成大小、形狀不一的大液滴,部分微粒粒徑增大到5 600 nm,而油相經膽鹽的乳化作用進一步會形成更小的油滴。實驗結果表明,經模擬口腔、胃消化后的乳液仍具有良好的雙重乳液結構,而乳液由于聚集作用,粒徑逐漸增大,最終在模擬腸道消化階段,雙重乳液結構破壞,釋放出的W1/O型乳液在胰酶的作用下分解并釋放出LOPs。
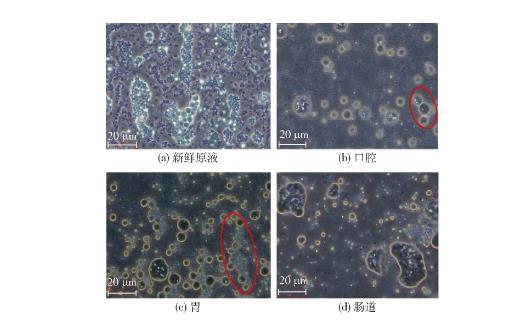
圖(b)中紅圈表示小液滴堆積在大液滴旁邊;圖(c)中紅圈表示小液滴高密度堆積成帶;光學顯微鏡放大倍數為(目鏡×物鏡)10×100。
圖7 LOPs的雙重乳液經模擬消化后的顯微照片










