合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
推薦新聞Info
-
> 不同水解時間的Protamex酶對玉米谷蛋白表面張力、泡沫、理化性質等的影響(三)
> 不同水解時間的Protamex酶對玉米谷蛋白表面張力、泡沫、理化性質等的影響(二)
> 不同水解時間的Protamex酶對玉米谷蛋白表面張力、泡沫、理化性質等的影響(一)
> 新型納米材料2-D納米黑卡在油水界面的微觀驅油機理、界面張力測定(三)
> 新型納米材料2-D納米黑卡在油水界面的微觀驅油機理、界面張力測定(二)
> 新型納米材料2-D納米黑卡在油水界面的微觀驅油機理、界面張力測定(一)
> 燒結礦致密化行為研究:不同堿度條件下熔體的表面張力、表觀黏度值(三)
> 燒結礦致密化行為研究:不同堿度條件下熔體的表面張力、表觀黏度值(二)
> 燒結礦致密化行為研究:不同堿度條件下熔體的表面張力、表觀黏度值(一)
> 如何提高非離子表面活性劑的表面張力預測精度
不同水解時間的Protamex酶對玉米谷蛋白表面張力、泡沫、理化性質等的影響(一)
來源:食品科學 瀏覽 27 次 發布時間:2025-07-03
摘要:采用Protamex酶對玉米谷蛋白進行水解,研究不同水解時間對玉米谷蛋白的泡沫性質、表面張力、理化性質、拉曼光譜及靜態流變學性質等的影響。結果表明,Protamex酶水解顯著改善玉米谷蛋白的溶解性和泡沫性質,在120 min水解物的起泡力最大,是原玉米谷蛋白的2.8倍左右,泡沫穩定性表現良好。此時水解物的表面張力最低、表觀黏度最高,所形成泡沫的微觀形態細膩均勻、蛋白膜較厚。隨著水解時間延長,玉米谷蛋白水解物的平均粒徑持續減小、內源熒光強度和表面疏水性逐漸增加,而表面凈電荷呈先減小后增加的變化趨勢。拉曼光譜分析結果表明適當水解使α-螺旋含量減少、無規卷曲和β-轉角含量增高、酪氨酸殘基峰強比(I850/I830)增強、色氨酸殘基峰強比(I760)降低,但對β-折疊含量影響較小;長時間水解使無規卷曲含量顯著增加,酪氨酸殘基峰強比(I850/I830)降低。因此,通過限制性水解作用可改變玉米谷蛋白的結構及界面性質、改善其泡沫性質,提高玉米蛋白在食品領域中的潛在利用率。
2021年,全國玉米產量約27 255萬t,玉米加工副產物總量可達7 000萬t左右。玉米蛋白粉(corn gluten meal,CGM)是濕法生產玉米淀粉的主要副產物之一,其蛋白質質量分數為55%~65%,是一種豐富的植物蛋白質資源。玉米蛋白質由68%醇溶蛋白、22%谷蛋白及少量白蛋白和球蛋白等組成,水溶性差,不適宜直接在食品行業中的應用,而通常是作為飼料或直接廢棄。玉米谷蛋白主要由谷氨酰胺、亮氨酸、脯氨酸、苯丙氨酸及結氨酸等氨基酸組成,酰胺基氨基酸比例較高,是天然表面活性劑的良好來源。但玉米谷蛋白是由大約20多種分子質量在11~127 ku的不同蛋白質亞基以二硫鍵為主要相互作用力而緊密連接的巨大、復雜的大分子蛋白質,且僅能溶于稀堿溶液。這導致其很難在食品體系中發揮起泡或乳化作用。因此,本研究希望通過適度修飾玉米谷蛋白結構,增強谷蛋白在氣/水界面吸附的能力,從而改善其起泡性質,拓寬玉米谷蛋白在蛋糕、啤酒、冰淇淋以及攪打稀奶油等制品中的應用。
已有研究表明物理和化學方法能夠提高谷蛋白的功能性質。Zhao Meng等發現通過堿熱處理大米谷蛋白可提升其起泡性及泡沫穩定性;Wang Yang等采用低功率密度超聲法對CGM進行改性發現CGM局部的氨基酸序列相互作用發生改變,此外,劉金玲和Wang Yaru等分別采用糖基化以及磷酸化等化學修飾法對玉米谷蛋白和大米谷蛋白樣品進行改性,結果表明玉米谷蛋白和大米谷蛋白的功能性質顯著提高。酶水解法也是蛋白質改性的有效方法,具有反應條件溫和、毒副作用小等優點,在食品蛋白質深加工中應用廣泛。Wang Yonghui等采用Alcalase酶水解CGM并與單寧酸復合,其混合物的起泡性及氣/水界面行為均顯著優于玉米蛋白;Klost等則利用胰蛋白酶對豌豆分離蛋白進行水解,發現水解可有效提高蛋白質的溶解性、乳化性等功能性質并且對豌豆分離蛋白的界面性質也產生了積極的影響。但有報道稱過度水解會導致蛋白質分子結構遭到劇烈破壞反而使其功能性質降低,由于過小的肽段會失去某些形成幾種功能特性所需的蛋白質網絡結構的能力,從而影響其功能性質。因此,對玉米谷蛋白進行適度的水解必不可少。Protamex是經枯草芽孢桿菌發酵而制得,屬于內切蛋白酶,具有廣泛的酶切位點,使具有緊密空間結構的大分子質量玉米谷蛋白的肽鍵斷裂。
本研究在前期研究結果基礎上,采用Protamex酶解玉米谷蛋白,以不同酶解時間表示水解進程,探討不同酶解時間條件下玉米谷蛋白的起泡性、泡沫微觀形態、表面張力、靜態流變學特性、粒徑分布及結構性質的變化情況,以期為蛋白酶適度修飾技術在玉米蛋白質上的應用提供一定的理論依據,從而促進玉米蛋白質的高值化應用。
1材料與方法
1.1材料與試劑
CGM購自黑龍江龍鳳玉米開發有限公司,蛋白質質量分數為65%(以干基計算)。
Protamex酶(食品級)丹麥諾維信公司;α-淀粉酶(食品級)北京奧博星生物技術有限責任公司;8-苯胺-1-萘磺酸(8-(phenylamino)naphthylamine-1-sulfonic acid,ANS)美國Sigma公司;其他試劑均為國產分析純。
1.2儀器與設備
T25高速分散機德國IKA公司;ZEN3700納米激光粒度電位測定儀、kinexusPro+高級旋轉流變儀英國Malvern公司;BX53F熒光顯微鏡日本奧林巴斯公司;U-2910紫外-可見分光光度計日本Hitachi公司;RF-6000熒光分光光度計日本島津公司;MacroRAM拉曼光譜儀堀場(中國)貿易有限公司。
1.3方法
1.3.1玉米谷蛋白的制備
先對CGM進行去淀粉、去醇溶蛋白處理,再采用堿提酸沉法提取谷蛋白。去淀粉:CGM分散于pH 6.5水溶液中,料液比1∶10(g/mL),置于65℃恒溫水浴磁力攪拌器中,加入1%(質量分數)的α-淀粉酶反應2 h,滅酶15 min后于4 000 r/min離心15 min,所得沉淀用純水洗滌3次,晾干、粉碎。去醇溶蛋白:去淀粉后樣品分散于70%乙醇溶液中,料液比1∶10(g/mL),置于60℃水浴中抽提醇溶蛋白,2 h后于4 000 r/min離心15 min,重復抽提2次,將沉淀晾干、粉碎。提取谷蛋白:將預處理后樣品以料液比1∶10分散于0.1 mol/L NaOH溶液,置于60℃恒溫水浴磁力攪拌器中提取2 h,于4 000 r/min離心15 min;取上清液用HCl(4 mol/L)溶液調節pH值至等電點,于4 000 r/min離心15 min,將沉淀用70%乙醇溶液和蒸餾水分別洗滌3次,并將pH值調回至7.0,將所得谷蛋白冷凍干燥、粉碎后過80目篩備用。
1.3.2 Protamex酶水解玉米谷蛋白
將1.3.1節所得玉米谷蛋白分散于蒸餾水中,底物質量濃度5 g/100 mL,按酶與底物之比0.81%加入Protamex酶,在pH 7.0、60℃條件下進行水解,期間以0.1 mol/L NaOH溶液維持pH值恒定,并采用pH-stat法測定水解度。水解反應分別進行10、30、60、120 min和150 min后,煮沸30 min滅酶,水解液于4 500 r/min離心15 min,所得上清液冷凍干燥后為水解物,待測。
1.3.3溶解性的測定
將2 mL離心管標記、稱量記為m1,稱取樣品0.1 g置于離心管中,再向離心管中加入1 mL的蒸餾水,旋渦振蕩10 min,后10 000 r/min離心10 min,棄去上清液,將沉淀物于80℃干燥8 h,最后將帶有沉淀物的離心管稱量記為m2。按照式(1)計算:

1.3.4泡沫性質的測定
樣品分散于蒸餾水中制成質量濃度為1 g/100 mL的蛋白溶液。取20 mL樣品溶液放置于50 mL燒杯中,記錄初始高度(H0),以13 500 r/min高速間歇攪打2 min,立刻記錄此時泡沫高度H1,室溫下靜置30 min后的記錄泡沫高度H2。起泡性和泡沫穩定性按照式(2)、(3)計算:
1.3.5泡沫宏觀和微觀形態觀察
按照1.3.4節方法將樣品溶液攪打起泡,用相機拍照記錄泡沫產生0、10、20 min和30 min的宏觀形態變化。同時取部分泡沫置于載玻片上,并于顯微鏡下觀察并記錄相應的微觀形態變化。
1.3.6表面張力的測定
將樣品配制為質量濃度1 g/100 mL的分散液,采用芬蘭Kibron公司生產的Delta-8全自動高通量表面張力儀按照GB/T 27842—2011《化學品動態表面張力的測定快速氣泡法》的方法測定其表面張力。
1.3.7粒徑及Zeta電位的測定
將樣品制為質量濃度1 mg/mL分散液并過0.22μm水系膜,設置溫度為25℃,蛋白折射率1.46,吸收參數1.33,溶劑為水,采用馬爾文納米激光粒度電位測定儀進行測定。
1.3.8內源熒光光譜的測定
將樣品制為質量濃度0.1 mg/mL的分散液,室溫下通過熒光分光光度計掃描其內源熒光強度。設定激發波長為290 nm,發射波長范圍300~400 nm,狹縫寬度5 nm。
1.3.9表面疏水性的測定
將樣品溶解并稀釋至蛋白質量濃度0.01~0.20 mg/mL之間。取5 mL樣品溶液加入25μL ANS試劑(濃度為8 mmol/L,溶于0.01 mol/L pH 7.0的磷酸鹽緩沖液)在室溫條件下反應15 min。設定熒光分光光度計的激發波長為390 nm,發射波長為470 nm,狹縫5 nm,分別測定樣品的熒光強度(FI0)和樣品加入ANS試劑后的熒光強度(FI1),FI1和FI0的差值記為FI,以蛋白質量濃度為橫坐標,FI為縱坐標作圖,曲線初始斜率即為樣品的表面疏水性指數。
1.3.10拉曼光譜的測定
將樣品平鋪在載玻片上進行拉曼光譜的測定,設置波長532 nm,掃描范圍400~2 000 cm-1,掃描10次,每個樣品3次累加,以苯丙氨酸(1 003±1)cm-1的譜峰強度作為歸一化因子并運用LabSpec6軟件對數據進行處理。
1.3.11靜態流變學的測定
樣品制為質量濃度為10 mg/mL的分散液,將樣品分散液緩慢傾注于于高級旋轉流變儀的樣品臺上。設定剪切速率為0.1~100 s-1,測試夾具為60 mm的錐板。將表觀黏度與剪切速率按照式(4)的冪律方程進行擬合:
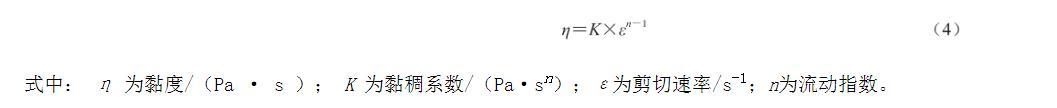
式中:η為黏度/(Pa·s);K為黏稠系數/(Pa·sn);ε為剪切速率/s-1;n為流動指數。
1.4數據統計與分析
每個實驗重復至少3次,結果用表示,采用SPSS Statistics 17.0軟件對結果進行ANOVA差異顯著性分析,P<0.05,差異顯著,采用OriginPro 2019b軟件作圖。










